|
Plný název analytu |
Anti-Műllerian
hormon (sérum) |
||||||
|
Název metody pro
nálezy |
S_AMH (Anti-Müllerian hormon) |
||||||
|
Synonymum názvu analytu |
AMH |
||||||
|
Analytický princip stanovení |
Imunochemická analýza |
||||||
|
Jednotky |
mg/l (pmol/l x 0.14 =
ng/ml, ng/ml x 7.14 = pmol/l) |
||||||
|
Vyšetřovaný biologický materiál |
Sérum |
||||||
|
·
odebírá
se |
Krev |
||||||
|
·
druh
odběru |
Srážlivá venózní krev |
||||||
|
·
odebírané
množství (ml) |
3 |
||||||
|
·
manipulace
s materiálem |
Zabraňte hemolýze |
||||||
|
Poznámka |
Vyšetření není do 31.12.2023 hrazeno ze
zdravotního pojištění !!! |
||||||
|
Dostupnost vyšetření po doručení vzorku do
laboratoře (H=hodina, D=den,
T=týden) |
1
H |
2
H |
4
H |
1 D |
2-3 D |
1
T |
2-3
T |
|
Referenční hodnoty (RH) (M
= muž, F = žena, R = rok, M = měsíc, D = den) |
|||||||
|
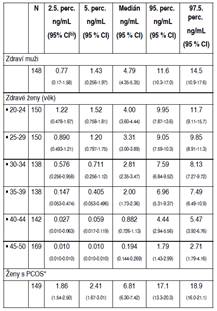
Viz
tabulka: Studie
bělošské populace se stanovením Elecsys AMH Plus na vzorcích zdravých
dospělých (148 mužů, 887 žen neužívajících hormonální antikoncepci) a 149 žen
s PCOS poskytl následující výsledky (studie Roche č. RD001727). |
|||||||
Stanovení
AMH lze využít při různých klinických indikacích.
§ Měření sérových
koncentrací AMH se klinicky používá zejména pro posouzení ovariální rezervy, která
odráží množství antrálních a preantrálních folikulů, tzv. počet antrálních
folikulů (AFC) a pro předpověď odpovědi na kontrolovanou stimulaci ovarií.
§ Dalším klinickým
použitím AMH jsou diagnostika poruch pohlavního vývoje u dětí a monitorování
reziduální nebo rekurentní nemoci při nádorech z buněk granulózy.
§ Podle některých
názorů se AMH doporučuje jako náhradní biomarker za AFC v diagnostice
syndromu polycystických ovarií (PCOS) a k predikci nástupu menopauzy.
§ Studie ukazují, že
koncentrace AMH se zvyšují v nádorech granulózních buněk vaječníků a AMH tak
může plnit funkci citlivého a specifického markeru v následných vyšetřeních
pacientek s odstraněnými vaječníky. Včasná detekce AMH je velmi důležitá,
protože nádory granulózních buněk jsou charakterizovány vysokou mírou
opakování.
§ U dívek před
pubertou výzkumné studie prokázaly, že stanovení AMH pomáhá odlišit gonadální a
negonadální příčiny mírné virilizace. Nestanovitelné hladiny AMH jsou zjištěny
u 46,XX předpubertálně virilizovaných děvčat, zatímco nadprůměrné hladiny
ženského AMH jsou zjištěny u dětí s poruchami tvorby testosteronu, syndromem
testikulární feminizace, dysgenetickými varlaty a ovotestes. Extrémně vysoké
koncentrace AMH jsou zjištěny u dívek s nádory vaječníku virilizujících
Sertoliho-Leydigových buněk.
§ Incidence
kryptorchismu je 3–6 % u novorozených chlapců narozených v řádném termínu a
klesá na 1–2 % ve třech měsících věku kvůli spontánnímu poklesu varlat. Studie
ukazují, že koncentrace AMH mohou odlišit nepokleslá varlata, jež vykazují
normální koncentraci AMH, od anorchie, jež vykazuje extrémně nízké nebo
neměřitelné koncentrace.
§ Studie věnující se
mezipohlavnímu srovnání u dětí ukazují, jež koncentrace AMH odrážejí funkci
Sertoliho buněk a často se určují ve spojení s měřením testosteronu. Abnormální
vývoj varlat je charakterizován nízkými koncentracemi AMH i testosteronu ve srovnání
se zdravými muži. Hormon AMH byl rovněž zkoumán ve spojení s měřením FSH, LH a
testosteronu v souvislosti s předčasnou a opožděnou pubertou u chlapců.
Antimülleriánský
hormon je homodimerický glykoprotein patřící do skupiny transformujícího
růstového faktoru β (TGF β). Všichni členové této superskupiny se
účastní regulace růstu tkání a jejich diferenciace. Hormon prochází před
sekrecí glykosylací a dimerizací a vznikne cca 140 kDa prekurzor dvou
identických disulfidických 70 kDa podjednotek. Každý monomer obsahuje velký N‑terminální pro-region a mnohem menší zralou C‑terminální doménu. Na rozdíl od ostatních
členů skupiny TGF β se u AMH předpokládá, že k dosažení plné bioaktivity
vyžaduje N‑terminální doménu pro umocnění aktivity C‑terminální domény. Část AMH se poté během
cytoplazmatického přenosu štěpí na specifickém místě mezi pro-regionem a zbylou
částí za vzniku biologicky aktivních N‑terminálních a C‑terminálních homodimerů o hmotnosti 110 kDa,
resp. 25 kDa, které zůstávají asociované v nekonvalentním komplexu. Receptor
AMH typu II (AMH RII) má schopnost vázat pouze biologicky aktivní formu AMH.
U
mužů se AMH vytváří v Sertoliho buňkách varlat. V průběhu embryonálního
vývoje u mužů je sekrece AMH ze Sertoliho buněk varlat zodpovědná za regresi
Müllerových vývodů a normální vývoj mužského pohlavního systému. Sekrece AMH
Sertoliho buňkami začíná během embryogeneze a pokračuje v průběh celého
života. AMH se až do puberty neustále vytváří ve varlatech a poté pomalu klesá
k postpubertálním
hodnotám.
U
žen hraje AMH významnou roli v ovariální folikulogenezi. Vývoj folikulů v
ovariích zahrnuje dva rozdílné stupně: počáteční výběr, při kterém dochází k
dospívání primordiálních folikulů, a cyklický výběr, který vede k růstu kohorty
malých antrálních folikulů, mezi nimiž je následně vybrán dominantní folikul
(určený k ovulaci). FSH (folikuly stimulující hormon) ovládá cyklický výběr.
Tvorba AMH v granulózních buňkách začíná v primárních folikulech a je největší
v granulózních buňkách preantrálních a malých antrálních folikulů do průměru
cca 6 mm. Až se stane růst folikulů závislý na FSH, tvorba AMH klesá a stává se
nedetekovatelnou. Toto schéma tvorby AMH podporuje inhibiční roli AMH ve 2
rozdílných stupních folikulogeneze. V první AMH inhibuje přechod folikulů z
primordiální na maturační stupeň a tím významně reguluje počet folikulů
zbývajících v primordiálním poolu. Ve druhé má AMH inhibiční účinek na
folikulární citlivost na FSH a tak sehrává roli v procesu folikulárního výběru.
Hladiny
AMH v séru jsou u žen při porodu téměř nedetekovatelné, nejvyšší hodnoty
dosahují po pubertě, poté postupně s věkem klesají a při menopauze se stávají
nedetekovatelnými. Hladiny AMH v séru jsou během menstruačního cyklu relativně
stabilní, se značnými výkyvy pozorovanými u mladých žen. Hladiny AMH dále
vykazují nižší intraa intercyklickou variaci než základ FSH. Hladiny AMH v séru
výrazně klesají při užívání kombinované hormonální antikoncepce.